
Myasthenia gravis
Die generalisierte Myasthenia gravis (gMG) ist eine seltene chronische Autoimmunkrankheit. Dabei kommt es infolge fehlgesteuerter Immunreaktionen zu Störungen der neuromuskulären Übertragung.
Home Seltene Krankheiten Komplementerkrankungen
Von Komplementerkrankungen haben viele Menschen vermutlich noch nicht gehört und keine Vorstellung davon, was sich hinter diesem Begriff verbirgt. Grund dafür dürfte sein, dass es sich bei komplementvermittelten Krankheiten weitgehend um Erkrankungen handelt, die nur wenige Personen betreffen – und deshalb teilweise Ärzte vor Herausforderungen stellt. Umso wichtiger ist es, auf diese seltenen Erkrankungen aufmerksam zu machen. Dank intensiver medizinischer Forschung kann man heutzutage die Vorgänge, die sich durch eine fehlerhafte Aktivierung oder Regulation des Komplementsystems im Körper abspielen, besser verstehen und Patienten mit innovativen Therapieansätzen eine effektive Behandlung ermöglichen.
In diesem Beitrag haben wir Ihnen ausführliche Informationen über die Entstehung, Ursachen, Symptome und Behandlungen von Komplementerkrankungen zusammengestellt:
Das Komplementsystem: Was ist das, welche Aufgaben erfüllt es und wie wird es in Gang gesetzt?
Komplementdefekte: Was kann das Komplementsystem aus dem Gleichgewicht bringen?
Komplementerkrankungen: Welche Organsysteme sind betroffen?
Diagnose: Wie werden Komplementerkrankungen festgestellt?
Komplementerkrankungen werden durch verschiedene Störungen im Komplementsystem hervorgerufen. Um die Komplexität von komplementvermittelten Erkrankungen zu verstehen, lohnt es sich einen Schritt zurückzugehen und das Komplementsystem als Teil unserer körpereigenen Immunabwehr zu betrachten.
Der Schutz des menschlichen Körpers vor Eindringlingen ist für die Erhaltung der Gesundheit sehr wichtig. Dabei helfen ihm die Haut und die Schleimhäute, um sich von der Umwelt abzugrenzen. Wird diese Barriere z. B. durch eine Verletzung der Haut von Bakterien, Pilzen oder Viren überwunden, können sie Infektionen auslösen. Das Immunsystem hilft, diese Eindringlinge zu erkennen und zu bekämpfen.
Der menschliche Organismus setzt für die Erkennung und Abwehr von Eindringlingen und entarteten Zellen auf verschiedene Strategien. Der angeborene Teil des Immunsystems ist hierbei schon ab der Geburt in Aktion. Die erworbene Körperabwehr wird hingegen nach einem Erstkontakt mit einem Eindringling aktiv und bekämpft diesen dann zielgerichtet. Eine Herausforderung für das Immunsystem besteht darin, einerseits Eindringlinge, fremde Materialien oder entartete Zellen (Krebszellen) zu erkennen und zu bekämpfen, andererseits das gesunde körpereigene Gewebe zu tolerieren und nicht anzugreifen.
Die angeborene Immunantwort stellt dem Körper eine Reihe an Reaktionsmöglichkeiten zur Verfügung, die ihn zu einer breit angelegten Erregerabwehr befähigen. Spezialisierte weiße Blutkörperchen wie z. B. Fresszellen (Makrophagen) oder Killerzellen (NK-Zellen) können Zellen, die als fremd erkannt werden, bekämpfen. Der Erreger wird durch Zellgifte abgetötet oder aufgefressen. Der Vorteil dieser zellulären Immunantwort ist die schnelle Einsatzbereitschaft.
Neben dieser zellulär gestützten Immunantwort durch die weißen Blutkörperchen existiert im Blutplasma ein weiteres System zur Immunabwehr: Das sogenannte Komplementsystem besteht aus mehr als 40 Eiweißen (Proteinen). Dieses ebenfalls angeborene System kann durch komplexe Reaktionsketten Zellen angreifen und deren Zerstörung einleiten.
Als Ergänzung zur angeborenen Immunreaktion besitzt der Mensch mit der erworbenen Immunantwort ein System, das sehr spezifisch Eindringlinge erkennen und bekämpfen kann. Eine besondere Rolle spielen dabei die Lymphozyten. Wird ein neuer, bislang unbekannter Eindringling erkannt, wird die Produktion von Antikörpern gestartet. Diese Antikörper sind individuell auf den Erreger abgestimmt, um diesen zielgerichtet erkennen zu können. Aufgabe der Antikörper ist die Markierung fremder Strukturen, um dem Immunsystem zu signalisieren, dass diese ein zu bekämpfendes Ziel sind. So richtet sich die Immunreaktion gezielt gegen die markierten Eindringlinge und versucht diese zu neutralisieren.
Nach dem Erstkontakt bilden sich Gedächtniszellen, die bei einem erneuten Feindkontakt schneller reagieren können und dann eine größere Menge an Antikörpern produzieren. Vorteil der erworbenen Immunabwehr ist, dass sie eine auf den speziellen Erreger abgestimmte Reaktion auslöst. Nachteil dieses Reaktionsmuster ist, dass die Produktion der Antikörper nach dem Erstkontakt rund eine Woche dauert.
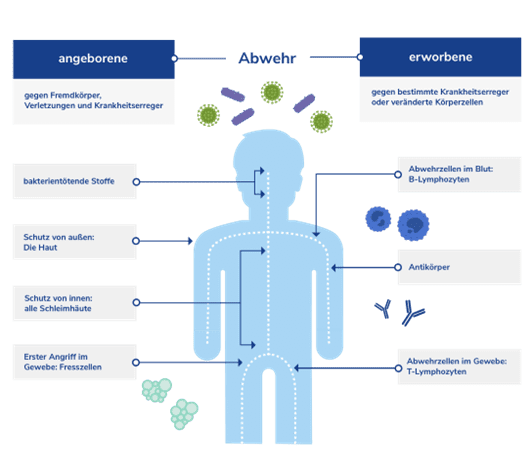
Bei den komplex ineinandergreifenden Reaktionen des Immunsystems spielt das Komplementsystem eine wichtige Rolle. Hauptaufgabe dieses angeborenen Systems ist, die Zerstörung von markierten Eindringlingen einzuleiten. Es handelt sich um eine Reaktionskaskade mit über 40 beteiligten Proteinen. Da es sich um einen mehrstufigen Ablauf handelt, sind für jeden einzelnen Schritt bestimmte Eiweiße und Enzyme notwendig. Manche fördern die Reaktionskette, andere wirken hemmend als Regulatorproteine und verhindern so eine überschießende Immunantwort. Am Ende steht die Zerstörung der bekämpften Zelle durch einen Angriff auf ihre Zellmembran und das Auslösen von Entzündungsprozessen.
Das Komplementsystem kann auf drei verschiedene Wege in Gang gesetzt werden. Der klassische Weg der Aktivierung startet mit einem Eindringling, der durch Antikörper markiert wird und zerstört werden soll. Wird die Komplementreaktion ohne eine Beteiligung von Antikörpern gestartet, so wird dies als alternativer Weg bezeichnet.
Die Aktivierungsproteine können sich auch direkt an Zuckergruppen auf Bakterienoberflächen anlagern. Wird die Reaktionskette auf diesem Weg gestartet, so spricht man vom Lektin-Weg. Unabhängig vom Startpunkt münden die Reaktionskaskaden immer in die gleiche Endstrecke und greifen die Zellmembran des Eindringlings an, um diesen dadurch zu zerstören. Zudem werden Entzündungsprozesse initiiert.
Die Funktionen und verschiedenen Aktivierungswege des Komplementsystems werden im Video anschaulich dargestellt.
Sie sehen gerade einen Platzhalterinhalt von YouTube. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenDas Komplementsystem steht vor der Herausforderung einerseits angemessen und in ausreichendem Maße zu reagieren und andererseits keine unangemessen starke und überschießende Reaktion anzustoßen. Entscheidend ist ein Gleichgewicht von fördernden und hemmenden Faktoren. Herrscht z.B. ein Mangel an einem Komplementfaktor, der für den regelhaften Ablauf der Komplementkaskade notwendig ist, wird die Reaktionskette an dieser Stelle unterbrochen oder läuft nur vermindert weiter. Die Reaktion des Immunsystems fällt zu gering aus. Fehlt dagegen ein Komplementregulator, kann die Reaktion des Immunsystems auch überbordend ausfallen.
Störungen des Komplementsystems können an verschiedenen Stellen lokalisiert sein. Es sind Defekte der Aktvierungsproteine bekannt, so dass z. B. ein Start über den klassischen oder der Lektin-Weg beeinträchtigt ist. Es können auch einzelne Proteine im Reaktionsweg in zu geringer Konzentration vorliegen oder hemmende Regulatorproteine einen Defekt aufweisen. Möglich ist auch eine unerwünschte Aktivierung des Komplementsystems durch Autoantikörper.

Die generalisierte Myasthenia gravis (gMG) ist eine seltene chronische Autoimmunkrankheit. Dabei kommt es infolge fehlgesteuerter Immunreaktionen zu Störungen der neuromuskulären Übertragung.

Beim atypischen Hämolytisch-Urämischen Syndrom, kurz aHUS genannt, handelt es sich um eine chronische Erkrankung, die durch eine übermäßige Aktivität des Komplementsystems hervorgerufen wird.

Die Hypophosphatasie ist eine erblich bedingte Stoffwechselerkrankung, die sich auf Knochen, Zähne, Muskulatur und weitere Körperfunktionen auswirken kann.

Charakteristisch für die Krankheiten sind Entzündungen von Sehnerv, Rückenmark oder Gehirn, die schubweise auftreten.

Eine komplexe Bluterkrankung mit vielfältigen Symptomen. Hier finden Sie alle Infos.

Die generalisierte Myasthenia gravis (gMG) ist eine seltene chronische Autoimmunkrankheit. Dabei kommt es infolge fehlgesteuerter

Beim atypischen Hämolytisch-Urämischen Syndrom, kurz aHUS genannt, handelt es sich um eine chronische Erkrankung, die

Die Hypophosphatasie ist eine erblich bedingte Stoffwechselerkrankung, die sich auf Knochen, Zähne, Muskulatur und weitere

Charakteristisch für die Krankheiten sind Entzündungen von Sehnerv, Rückenmark oder Gehirn, die schubweise auftreten.

Eine komplexe Bluterkrankung mit vielfältigen Symptomen. Hier finden Sie alle Infos.
Bei einem Großteil der komplementassoziierten Krankheitsbilder handelt es sich um seltene Erkrankungen (rare oder orphan diseases). Davon spricht man, wenn weniger als 500 Menschen pro 1 Million Einwohner betroffen sind. Als sehr selten (ultra rare) gilt eine Erkrankung, die lediglich bis zu 20 Patienten pro 1 Million Menschen betrifft.
Es sind sowohl vererbte als auch erworbene Komplementdefekte bekannt. Liegt die Ursache für die Störung des Komplementsystems in einem defekten Gen, bezeichnet man das als primären oder hereditären Komplementdefekt. In den meisten Fällen ist die Vererbung autosomal-rezessiv, d. h. der Betroffene hat von beiden Elternteilen ein defektes Gen geerbt. Liegt in diesem Fall aber nur auf einem der beiden paarigen Chromosomen ein Defekt vor, dann führt dies nicht zu klinischen Symptomen.
Erworbene Komplementstörungen können z.B. bei einem zu hohen entzündungsbedingten Verbrauch von Komplementfaktoren oder der Existenz von Autoantikörpern gegen ein Komplementprotein beobachtet werden. Liegt eine fehlerhafte Komplementaktivierung durch eine Autoimmunerkrankung zugrunde, ist diese häufig erworben.
Da das Komplementsystem im Rahmen der Immunabwehr im gesamten Körper aktiv ist, können sich Störungen vielfältig auf die Organsysteme auswirken. Um den Überblick zu erleichtern, wird eine Einteilung nach den hauptsächlich betroffenen Systemen vorgenommen. Es werden beispielhaft einige seltene Erkrankungen dargestellt, um die Auswirkungen von Störungen des Komplementsystems aufzuzeigen.
Erkrankungen, bei denen das Auge oder die Sehbahn betroffen ist, gefährden und beeinträchtigen die Sehfähigkeit der Patienten.
Bei den Neuromyelitis-optica-Spektrum-Erkrankungen (NMOSD, auch Devic-Syndrom genannt) handelt es sich um eine Gruppe von seltenen Autoimmunerkrankungen, bei denen das zentrale Nervensystem betroffen ist. Die Krankheit tritt schubweise auf und ist durch Entzündungen des Sehnervs sowie des Rückenmarks gekennzeichnet.
Betroffen sind von der NMOSD ca. 10 bis 30 Menschen pro eine Million Einwohner. Bei ca. 75 % der Betroffenen bildet der Körper Aquaporin-4 (AQP4)-Autoantikörper, die sich gegen das körpereigene Eiweiß AQP4, das bei speziellen Stützzellen (Astrozyten) im zentralen Nervensystem (ZNS) eine wichtige Rolle spielt, richten. Überwinden diese Autoantikörper die Blut-Hirn-Schranke, lagern sie sich im Zentralnervensystem (ZNS) an die Zellmembran an. AQP4-Autoantikörper binden sie an das Wasserkanal-Protein AQP4 auf den Astrozyten und aktivieren das Komplementsystem über den klassischen Weg, was zu Entzündungsreaktionen und Nervenschäden führt. Ist der Sehnerv entzündet (Optikusneuritis), können sich Sehstörungen zeigen, die von einem Verlust des Farbsehens über Gesichtsfeldausfälle bis zu dauerhaften Sehminderungen oder Erblindung reichen können. Als Folge einer Entzündung im Rückenmark (transverse Myelitis) können Gefühlsstörungen in den Extremitäten und beidseitige Muskelschwächen von Armen und Beinen auftreten sowie Krämpfe, Schmerzen und Lähmungen. Zusätzlich treten bei mehr als jedem fünften Betroffenen generalisierte Symptome wie Fatigue (starke Erschöpfungserscheinungen und Müdigkeit) auf. Außerdem können Verdauungs- und Entleerungsstörungen sowie eine sexuelle Dysfunktion auftreten. Nach einem NMOSD-Schub kommt es häufig zu bleibenden Beeinträchtigungen.
Eine weitere Erkrankung, die die Sehfähigkeit beeinträchtigt, ist die geographische Atrophie. Es handelt sich dabei um eine Spätform der trockenen altersbedingten Makuladegeneration (AMD), bei der die Netzhaut im Auge durch das Krankheitsgeschehen irreversibel geschädigt wird. Die geschädigten Areale der Netzhaut nehmen dabei immer weiter zu. Bei der Entstehung der geographischen Atrophie spielt auch eine überbordende Komplementaktivierung eine wesentliche Rolle.
Weltweit sind mehr als 5 Millionen Menschen betroffen. Die Erkrankung entwickelt sich langsam und äußert sich anfänglich durch verschwommenes Sehen. Da hauptsächlich ältere Menschen betroffen sind, wird das nachlassende Sehvermögen oft irrtümlich als typische Alterserscheinung gewertet.
Bei der generalisierten Myasthenia gravis (gMG) wirkt sich die Aktivierung des Komplementsystems auf das Nervensystem und die Muskulatur aus. Die Übertragung der Nervenimpulse vom ZNS zum Muskel kann hierbei gestört sein, auch eine Schädigung des Gewebes ist möglich.
Die generalisierte Myasthenia gravis (gMG) ist eine chronische Autoimmunkrankheit, bei der es zu einer schweren Muskelschwäche kommt, die sich auf Muskelgruppen im gesamten Körper auswirken kann. Ursache der Erkrankung ist die Bindung von Autoantikörpern an spezifische Strukturen der Muskelzellen, die die Übertragung von Nervensignalen an die Muskeln blockiert. Die Autoantikörper aktivieren mitunter das Komplementsystem, das die markierten Zellen angreift und schädigt. Diese Erkrankung führt zu einer Schädigung von Geweben und Einschränkungen bei der Reizübertragung vom Nerv auf den Muskel, die sich als Muskelschwäche manifestiert. Typische Symptome der Myasthenia gravis sind Sehstörungen wie Doppelbilder oder das Herabhängen von einem oder beiden Augenlidern. Je nach Ausbreitung auf andere Muskelgruppen kann es zu Schwierigkeiten beim Sprechen und Kauen, Atembeschwerden oder einer Kopfhalteschwäche kommen.
Die Krankheitshäufigkeit wird auf 100 bis 200 Menschen pro 1 Million Einwohner geschätzt. Frauen sind von Myasthenia gravis etwa dreimal so oft wie Männer betroffen. Die Erkrankung kann in jeder Altersgruppe auftreten, am häufigsten wird sie bei Frauen unter 40 Jahren sowie bei Männern über 60 festgestellt.
Die paroxysmale nächtliche Hämoglobinurie (PNH) ist eine sehr seltene chronische Erkrankung, die das blutbildende System betrifft. Schätzungen zufolge tritt sie lediglich bei 16 Menschen pro 1 Million Einwohner auf.
Bei Menschen mit PNH fehlen gewisse Schutzproteine auf den roten Blutkörperchen (Erythrozyten), dadurch werden sie fälschlicherweise permanent vom Komplementsystem angegriffen und zerstört. Dieser Vorgang wird auch als chronische Hämolyse bezeichnet.
Die Verminderung der Erythrozyten kann sich bei betroffenen Personen mit verschiedenen unspezifischen Symptomen wie schwere Erschöpfung (Fatigue), Bauchschmerzen, Schluckstörungen, Atemnot, Erektionsstörungen oder einer Dunkelfärbung des Urins durch die Ausscheidung des Farbstoffs Hämoglobin bemerkbar machen. Die übermäßige Zerstörung der roten Blutkörperchen führt zu Blutarmut. Wird die PNH nicht behandelt, sammeln sich schädliche Abbauprodukte im Blut, was die Bildung von Blutgerinnseln (Thrombosen) fördert und zu chronischen Nierenerkrankungen führen kann. Als Folge von Thrombosen kann es zu schwerwiegenden Organschäden an Leber, Lunge und Gehirn kommen.
Beim atypischen Hämolytisch-Urämischen Syndrom (aHUS) handelt es sich um eine Erkrankung, die auf einer Regulationsstörung des Komplementsystems beruht. Infolgedessen entstehen Blutgerinnsel im gesamten Körper, was zu einer beeinträchtigten Durchblutung und dauerhaften Schädigung lebenswichtiger Organe führen kann. Bei etwa 50 Prozent der Patienten führt dies innerhalb kurzer Zeit zu einem vollständigen Nierenversagen und macht eine Dialysebehandlung notwendig.
Die Erkrankung ist äußerst selten, auf 1 Million Einwohnern kommen lediglich ein bis zwei Fälle. Das atypische Hämolytisch-Urämische Syndrom kann genetisch bedingt oder erworben sein, zusätzlich können verschiedene Ereignisse wie Schwangerschaft, Infektionen, Operationen, bestimmte Krankheiten und Medikamente die Erkrankung auslösen oder verschlimmern. aHUS kann in jeder Altersgruppe – auch bereits bei Säuglingen auftreten. Bei einem Ausbruch im Erwachsenenalter sind Frauen häufiger betroffen.
Zu den komplementvermittelten Erkrankungen, die die Niere betreffen, gehört auch Lupus Nephritis. Die schwere Nierenentzündung tritt bei etwa 25 bis 50 Prozent der Patienten im Rahmen des systemischen Lupus erythematodes (SLE) auf. SLE stellt eine chronisch-entzündliche Autoimmunerkrankung dar, die meist in Schüben verläuft und verschiedene Organe betreffen kann. Sind die Nieren betroffen, lagern sich die Immunkomplexe in den Nierenkörperchen ab und das Komplementsystem wird aktiviert. Die Schädigung der Nieren ist bei bis zu jedem dritten Betroffenen so ausgeprägt, dass sie dialysepflichtig werden.
Komplementerkrankungen gehen oft mit unspezifischen Symptomen einher, die auch bei zahlreichen anderen Krankheiten beobachtet werden können. Zudem sind sie selten, so dass behandelnde Ärzte oft als Erstes andere Krankheiten in Betracht ziehen. Deshalb vergehen teilweise Jahre, bis die richtige Diagnose gestellt wird.
Zur Stellung und Sicherung der Diagnose kommt neben einer ausführlichen Erhebung der Krankengeschichte eine jeweils auf den Einzelfall abgestimmte Palette an Untersuchungen zum Einsatz.
Besteht zum Beispiel der Verdacht, dass die Aktivität eines bestimmten Enzyms vermindert ist, stehen heutzutage empfindliche Messmethoden zur Bestimmung der Enzymaktivität zur Verfügung. Bei einem Hinweis auf eine Autoimmunerkrankung kann ein Nachweis von spezifischen Antikörpern angezeigt sein. Gibt es z.B. durch die Familiengeschichte den Verdacht auf eine vererbte Komplementstörung, können genetische Untersuchungen zur Erkennung von Gendefekten hilfreich sein.
Häufig sind Ultraschall, Computertomographie (CT), Magnetresonanztomographie (MRT), Messungen der Nervenleitgeschwindigkeit und weitere Blutuntersuchungen (z.B. Nachweis von Autoantikörpern) notwendig, um die Diagnose zu sichern und andere Erkrankungen auszuschließen.
Wie bereits beschrieben gehen Komplementerkrankungen häufig mit einer komplexen Symptomatik einher, die selbst vom Facharzt nicht immer eindeutig zugeordnet werden kann und deshalb die Diagnosestellung erschwert bzw. zu deutlichen Verzögerungen führt. Eine gute Anlaufstelle für Betroffene stellen spezialisierte medizinische Zentren dar, die sich mittlerweile in einigen größeren deutschen Städten etabliert haben. Zwar mag es für Betroffene einen größeren Aufwand bedeuten, wenn ein Ärztezentrum außerhalb des Wohnortes aufgesucht werden muss, jedoch stehen dort in der Regel mehr Expertise und differentialdiagnostische Untersuchungsmethoden zur Verfügung. Zudem bieten spezialisierte Einrichtungen einen Zugang zu neuen Therapieoptionen und können dank der Zusammenarbeit von Fachärzten und Therapeuten aus verschiedenen Disziplinen eine auf den jeweiligen Einfall abgestimmte Behandlung ermöglichen.
Ausführliche Informationen über Ursachen und Symptome seltener komplementvermittelter Erkrankungen, Behandlungsmethoden und medizinische Einrichtungen finden Patienten und deren Angehörige auf den Portalen von Patientenorganisationen und Selbsthilfe-Vereinen. Darüber hinaus eröffnen die Initiativen die Möglichkeit, sich mit anderen Betroffenen auf Veranstaltungen und online über eigene Erfahrungen auszutauschen und sich gegenseitig mit Tipps und Ratschlägen zu unterstützen.
| aHUS | Atypisches Hämolytisch-Urämisches Syndrom |
| autosomal-rezessiv | Form der Vererbung, Krankheit tritt nur auf, wenn auf beiden Chromosomen ein Gendefekt vorliegt |
| Aktivierungsprotein | Startet die Reaktionskaskade des Komplementsystems |
| Antikörper | Spezielle Eiweiße, die spezifische Strukturen erkennen und markieren können; Teil des Immunsystems |
| atypisch | Nicht der Norm entsprechend |
| Autoantikörper | Antikörper, die sich fälschlicherweise gegen körpereigenes Gewebe richten |
| Autoimmunerkrankung | Erkrankung, bei der der Körper körpereigene Strukturen angreift |
| Blut-Hirn-Schranke | Barriere zwischen dem Gehirn und der Blutbahn |
| chronisch | Dauernd vorhanden, lang anhaltend |
| Erythrozyten | Rote Blutkörperchen, sind für den Sauerstofftransport zuständig |
| Gedächtniszellen | Werden nach Erstkontakt mit Erreger gebildet, ermöglichen bei Zweitkontakt schnellere Antikörperproduktion |
| generalisiert | im gesamten Körper ausgebreitet |
| gMG | generalisierte Myasthenia gravis |
| gravis | schwer |
| hämatologisch | Die Hämatologie bzw. das blutbildende System betreffend |
| Hämolyse | Zerstörung roter Blutkörperchen |
| hereditärer Komplementdefekt | genetisch bedingte Störung des Komplementsystems |
| Immunsystem | Mehrstufiges Abwehrsystem des Körpers, verantwortlich für die Erkennung und Bekämpfung von Krankheitserregern |
| Komplementsystem | Teil des angeborenen Immunsystems, unterstützt bei der Bekämpfung von Krankheitserregern |
| Leukozyten | Weiße Blutkörperchen. Ein Oberbegriff, der zahlreiche Untergruppen umfasst. Sind mit unterschiedlichen Aufgaben an der Immunabwehr beteiligt. |
| Lymphozyten | Untergruppe an Leukozyten, die eine wichtige Rolle im erworbenen Immunsystem spielen |
| Makrophagen | Fresszellen, können andere Zellen und Fremdkörper in das Zellinnere aufnehmen und verdauen |
| Multiple Sklerose (MS) | Chronisch entzündliche Autoimmunerkrankung des zentralen Nervensystems (ZNS) |
| Myasthenia | Muskelschwäche |
| neurologisch | Die Neurologie bzw. das Nervensystem betreffend |
| Neuromyelitis | Entzündung des Rückenmarks |
| Neuron | Nervenzellen, die Nervenimpulse zu einem Muskel oder dem nächsten Neuron weiterleiten |
| NK-Zellen | Natürliche Killerzellen, unterstützen die Immunabwehr |
| Optikusneuritis | Entzündung des Sehnervs |
| Plasma | Flüssiger Teil des Blutes, enthält unter anderem die Proteine des Komplementsystems |
| Protein | Eiweiß |
| Regulatorprotein | Reguliert und beeinflusst den Ablauf einer Enzymreaktion |
| renal | die Nieren betreffend |
| Urämie | Anreicherung des Blutes mit Stoffwechselprodukten, die normalerweise über die Niere ausgeschieden werden. Ein Hinweis auf eine mangelhafte Nierenfunktion |
| Zentralnervensystem (ZNS) | Umfasst Gehirn und Rückenmark |
Baines, Andrea C., und Robert A. Brodsky. 2017. „Complementopathies“. Blood Reviews 31 (4): 213–23.
Borisow, Nadja, Masahiro Mori, Satoshi Kuwabara, Michael Scheel, und Friedemann Paul. 2018. „Diagnosis and Treatment of NMO Spectrum Disorder and MOG-Encephalomyelitis“. Frontiers in Neurology 9 (Oktober): 888.
Carroll, Michael C. 2004. „The Complement System in Regulation of Adaptive Immunity“. Nature Immunology 5 (10): 981–86.
Devalet, Bérangère, François Mullier, Bernard Chatelain, Jean-Michel Dogné, und Christian Chatelain. 2015. „Pathophysiology, Diagnosis, and Treatment of Paroxysmal Nocturnal Hemoglobinuria: A Review“. European Journal of Haematology 95 (3): 190–98.
Devos, Timothy, Stef Meers, Nancy Boeckx, Andre Gothot, Dries Deeren, Bernard Chatelain, Christian Chatelain, und Bérangère Devalet. 2018. „Diagnosis and Management of PNH: Review and Recommendations from a Belgian Expert Panel“. European Journal of Haematology 101 (6): 737–49.
Dunkelberger, Jason R, und Wen-Chao Song. 2010. „Complement and Its Role in Innate and Adaptive Immune Responses“. Cell Research 20 (1): 34–50.
Evans, William RH, und Imran Rafi. 2016. „Rare Diseases in General Practice: Recognising the Zebras among the Horses“. British Journal of General Practice 66 (652): 550–51.
Göschl, Lisa, Matthias Vossen, Clemens Scheinecker, Katharina Grabmeier-Pfistershammer, Winfried F. Pickl, und Elisabeth Förster-Waldl. 2019. „Diagnostik und Therapie bei primären Immundefekten/‚inborn errors of immunity“. Wiener klinische Wochenschrift Education 14 (1–4): 65–79.
Howard, James F. 2018. „Myasthenia Gravis: The Role of Complement at the Neuromuscular Junction: Role of Complement in Myasthenia Gravis“. Annals of the New York Academy of Sciences 1412 (1): 113–28.
Kirschfink, Michael. 2014. „Komplementsystem und Komplementdefekte“. In Pädiatrie, herausgegeben von Georg F. Hoffmann, Michael J. Lentze, Jürgen Spranger, und Fred Zepp, 738–43. Berlin, Heidelberg: Springer Berlin Heidelberg.
Marshall, Jean S., Richard Warrington, Wade Watson, und Harold L. Kim. 2018. „An Introduction to Immunology and Immunopathology“. Allergy, Asthma & Clinical Immunology 14 (S2): 49.
Melis, Joost P. M., Kristin Strumane, Sigrid R. Ruuls, Frank J. Beurskens, Janine Schuurman, und Paul W. H. I. Parren. 2015. „Complement in Therapy and Disease: Regulating the Complement System with Antibody-Based Therapeutics“. Molecular Immunology 67 (2 Pt A): 117–30.
Merle, Nicolas S., Sarah Elizabeth Church, Veronique Fremeaux-Bacchi, und Lubka T. Roumenina. 2015. „Complement System Part I – Molecular Mechanisms of Activation and Regulation“. Frontiers in Immunology 6: 262.
Morgan, B. Paul, und Claire L. Harris. 2015. „Complement, a Target for Therapy in Inflammatory and Degenerative Diseases“. Nature Reviews. Drug Discovery 14 (12): 857–77.
Mutch, Kerry, Abigail Methley, Phil Moore, und Anu Jacob. 2014. „Life on Hold: The Experience of Living with Neuromyelitis Optica“. Disability and Rehabilitation 36 (13): 1100–1107.
Natzle, J. E., A. S. Hammonds, und J. W. Fristrom. 1986. „Isolation of Genes Active during Hormone-Induced Morphogenesis in Drosophila Imaginal Discs“. The Journal of Biological Chemistry 261 (12): 5575–83.
Panse, Jens. 2021. „Paroxysmale nächtliche Hämoglobinurie“. InFo Hämatologie + Onkologie 24 (10): 26–30.
Pettigrew, H. David, Suzanne S. Teuber, und M. Eric Gershwin. 2009. „Clinical Significance of Complement Deficiencies“. Annals of the New York Academy of Sciences 1173 (1): 108–23.
Raina, Rupesh, Vinod Krishnappa, Taryn Blaha, Taylor Kann, William Hein, Linda Burke, und Arvind Bagga. 2019. „Atypical Hemolytic-Uremic Syndrome: An Update on Pathophysiology, Diagnosis, and Treatment“. Therapeutic Apheresis and Dialysis: Official Peer-Reviewed Journal of the International Society for Apheresis, the Japanese Society for Apheresis, the Japanese Society for Dialysis Therapy 23 (1): 4–21.
Sanders, Donald B., Gil I. Wolfe, Michael Benatar, Amelia Evoli, Nils E. Gilhus, Isabel Illa, Nancy Kuntz, u. a. 2016. „International Consensus Guidance for Management of Myasthenia Gravis: Executive Summary“. Neurology 87 (4): 419–25.
Sarma, J. Vidya, und Peter A. Ward. 2011. „The Complement System“.Cell and Tissue Research 343 (1): 227–35.
Sathasivam, Sivakumar. 2014. „Diagnosis and Management of Myasthenia Gravis: Review“. Progress in Neurology and Psychiatry 18 (1): 6–14.
Schröder-Braunstein, Jutta, und Michael Kirschfink. 2019. „Complement Deficiencies and Dysregulation: Pathophysiological Consequences, Modern Analysis, and Clinical Management“. Molecular Immunology 114 (Oktober): 299–311.
Sridharan, Meera, Ronald S. Go, und Maria A. V. Willrich. 2018. „Atypical Hemolytic Uremic Syndrome: Review of Clinical Presentation, Diagnosis and Management“. Journal of Immunological Methods 461 (Oktober): 15–22.
Tudoran, Ruxandra, und Michael Kirschfink. 2012. „Moderne Komplementanalytik Indikationen – Methodik – Perspektiven/Modern complement analysis: indications, methods and outlook“. Laboratoriumsmedizin 36 (3).
Wingerchuk, D. M., W. F. Hogancamp, P. C. O’Brien, und B. G. Weinshenker. 1999. „The Clinical Course of Neuromyelitis Optica (Devic’s Syndrome)“. Neurology 53 (5): 1107–1107.
Du hast die Informationen erhalten, nach denen du gesucht hast? Das freut uns. Wir arbeiten täglich mit viel Enthusiasmus und Herzblut daran, medizinische Fragen ausführlich, verständlich und korrekt zu beantworten. Lass uns ein Like da. So wissen wir, dass unsere Inhalte ankommen.
Sie sehen gerade einen Platzhalterinhalt von Vimeo. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenSie sehen gerade einen Platzhalterinhalt von YouTube. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenSie müssen den Inhalt von reCAPTCHA laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr InformationenSie sehen gerade einen Platzhalterinhalt von Facebook. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenSie müssen den Inhalt von hCaptcha - Formidable laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr InformationenSie müssen den Inhalt von reCAPTCHA laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr InformationenSie müssen den Inhalt von Turnstile laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr Informationen